Im Kampf gegen die Schlafkrankheit
Adlershofer und Finnen wollen das aktive Zentrum der Thiolase blockieren
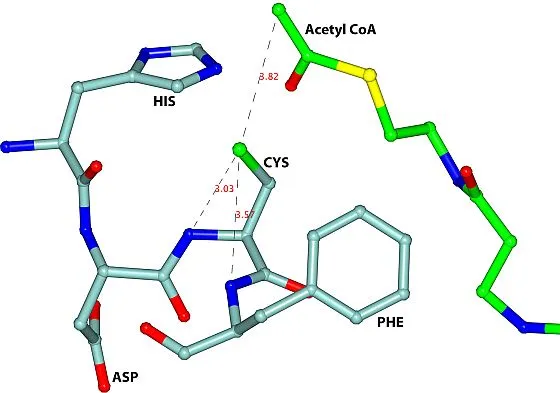
Wissenschaftler der finnischen Universität Oulu und des Helmholtz-Zentrum Berlin (HZB) haben neue Wege zur Medikamentenentwicklung gegen die afrikanische Schlafkrankheit und andere von Parasiten übertragene, tropische Erkrankungen aufgezeigt. Grundlage dafür sind Strukturuntersuchungen an einem als Thiolase bezeichneten Enzym.
Die afrikanische Schlafkrankheit Trypanosomiasis oder die indische Leishmaniose sind tropische Krankheiten, die von Parasiten ausgelöst werden. An ihnen erkranken Jahr für Jahr erkranken Millionen von Menschen, tausende sterben daran. Medikamente gegen die Parasiten sind teuer und haben häufig starke Nebenwirkungen. Zudem sind seit Jahrzehnten keine neuen, wirksamen Therapeutika entwickelt worden. Die Weltgesundheitsorganisation WHO misst Forschungen zur Entwicklung entsprechender Wirkstoffe deshalb besondere Bedeutung zu.
Wissenschaftler um Prof. Rik Wierenga von der Universität Oulu haben dafür die Grundlage geschaffen und die Struktur des Enzyms Thiolase aufgeklärt. Thiolase ist für den Lipid-Stoffwechsel der Parasiten unverzichtbar. „Entscheidend ist der Aufbau des aktiven Zentrums des Enzyms“, sagt Wierenga: „Hier docken die für den parasitären Stoffwechsel wichtigen Lipide an. Und hier finden die chemischen Reaktionen statt, mit denen die Lipide umgebaut werden.“ Die Struktur und die Funktion des aktiven Zentrums gelte es zu erforschen, so Wierenga: „Dann kann man Substanzen entwickeln, die die Lipide imitieren, fest an das aktive Zentrum des Enzyms andocken und es damit blockieren.“ Die entsprechenden Moleküle sind hervorragende Ausgangspunkte für die Entwicklung neuer Pharmazeutika.
Die Untersuchungen der Thiolase am BESSY haben ein sehr detailliertes Bild vom aktiven Zentrum der Thiolase ergeben: „Zudem haben wir jetzt eine viel bessere Vorstellung von der Funktion der Thiolase“, sagt Wierenga: „Es sieht so aus, als ob sie den ersten Schritt im Stoffwechselweg der Sterol-Biosynthese katalysiert. Er hat bei mehreren Parasiten große Bedeutung.“
„Die Vermessung kristalliner Thiolase-Proteine an unserer MX-Beamline hat die Geometrie des aktiven Zentrums im Enzym aufgedeckt“, sagt Dr. Manfred Weiss vom HZB. Dabei hat eine spezifische Windung im Proteinmolekül eine besondere Bedeutung, der so genannte HDCF-Loop. Die Struktur, die sehr tief im Inneren der Thiolase liegt, war bisher unbekannt. „Die Kenntnis der HDCF-Struktur ist ein idealer Ausgangspunkt zur Entwicklung neuer Medikamente gegen die Parasiten“, fasst Rik Wierenga zusammen.
Originalpublikation:
Harijan, R.K., Kiema, T.R., Karjalainen, M.P., Janardan, N., Murthy, M.R., Weiss. M.S., Michels, P.A., Wierenga, R.K. (2013) Crystal structures of SCP2-thiolases of Trypanosomatidae, human pathogens causing widespread tropical diseases: the importance for catalysis of the cysteine of the unique HDCF loop. Biochem J., 455, 119-130.
Bildunterschrift:
Ein Hauptmerkmal des aktiven Zentrums der trypanosomalen Thiolase ist der HDCF-Loop (HIS-ASP-CYS-PHE), dargestellt in hellem Blau. Grafik: University of Oulu
Weitere Informationen:
Dr. Manfred Weiss
Institut Weiche Materie und Funktionale Materialien
Tel.: +49 (0)30-8062-13149
manfred.weiss@helmholtz-berlin.de
Prof. Dr. Rik Wierenga
Biocenter Oulu, University of Oulu, Oulu, Finland
Tel.: +35 829448119
rik.wierenga@oulu.fi
Pressestelle
Hannes Schlender
Tel.: +49 (0)30-8062-42414
Fax: +49 (0)30-8062-42998
hannes.schlender@helmholtz-berlin.de